Yeni Geliştirilen Biyosensörler Lokalize Hücre Aktivitesinin Görüntülenmesini Kolaylaştırıyor. Yeni bir floresan biyosensör çeşidi, canlı hücrelerdeki son derece spesifik lokasyonlarda oluşan enzimatik ve hücre sinyal faaliyetlerini görselleştirmeyi mümkün kılmaktadır.
Bu gibi faaliyetler çoğunlukla 100 nm’lik dalga boylarında gerçekleşir ve onları gözlemlemek şu anda zor veya imkansızdır. Örneğin, görünür ışığın kırınım sınırı, ışık mikroskopisinin 200 ila 250 nm’den küçük bölgelerde dinamik olayları yakalamasını engeller.
SOFI (stochastic optical fluctuation imaging) gibi süper çözünürlük teknikleri, ışık mikroskoplarının kırınım sınırını kırmaktadır. Fakat dinamik biyolojik aktiviteleri değil yalnızca hücrelerdeki statik yapıları görüntüleyebilirler.
California Üniversitesinden, Jin Zhang ve meslektaşları, hücresel işlemleri görüntüleyebilmek için yaklaşık 100 nm’lik bir çözünürlüğe kadar SOFI için geliştirdikleri yöntem ile saptanabilir olan biyolojik sensörler geliştirdiler (Nat. Methods 2017, DOI: 10.1038 / Nmeth.4221).
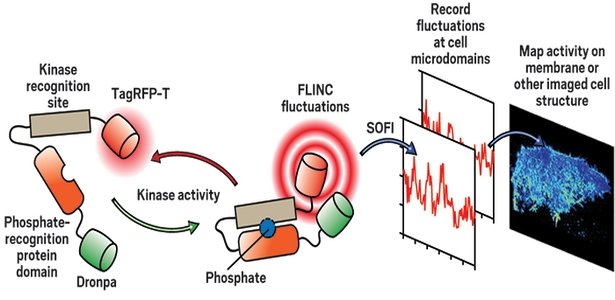
Araştırmacılar FLINC ( Fluorescence fLuctuation INcrease by Contact ) adı verilen yeni bir biyoalgılama fenomenini keşfettiler. İki fluoresan proteini yakın temasta olduğunda flüoresans dalgalanmalar hızlanır.
FRET (floresan rezonans enerji transferi) ve BiFC (bimoleküler floresan tamamlama) FLINC’yi anımsatan mekanizmalara sahiptir. Fakat FRET, süper çözünürlüklü görüntüleme ile kolayca uyumlu değildir ve BiFC, dinamik biyolojik aktiviteyi izleyemeyen tek seferde geri dönüşsüz bir flüoresans oluşturma süreci oluşturmaktadır.
Zhang ve arkadaşları, bir floresan protein olan Dronpa’nın, iki yakınında olduklarında başka bir proteinin, TagRFP-T’nin flüoresans dalgalanma oranlarını önemli ölçüde artırdığını keşfetti. Ekip, bu proteinlerin, bir enzim veya sinyal molekülünün tanıyıp değiştirebildiği bir peptid dizisinin herhangi bir ucuna yerleştirildiği biosensörler oluşturdu. Normalde, biyosensörler, iki proteinin uzakta kaldıkları genişlemiş konformasyonları vardır. Fakat bir enzim, örneğin fosforilasyon vasıtasıyla peptit dizisini modifiye ettiğinde, biyosensör kompakt bir şekle dönüşür. Bu, proteinlerin yakınına getirir ve görüntülenecek bir FLINC sinyaline geçer.
Zhang ve arkadaşları süper çözünürlükte hücre mikro alanlarındaki kinaz aktivitesini görselleştirmek için SOFI’li biyosensörleri kullandılar.
Oregon Sağlık ve Bilim Üniversitesi’nden biyomedikal optik uzmanı Xiaolin NanZhang’in grubu “FLINC’yi bir biyosensör tekniği olarak tanımlıyor, ancak protein-protein etkileşimleri gibi moleküller arasında yakınlık içeren tüm süreçler bu strateji kullanılarak incelenebilir”.
Kaynak : ACS